от профессора Аверьянова
Дышится легче
Авторы: А.В. Аверьянов1, А.С. Перкина1, 2
1 Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства: 115682, Россия, Москва, Ореховый бульвар, 28.
2 Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства: 115682, Россия, Москва, Ореховый бульвар, 28.
Резюме
Общая вариабельная иммунная недостаточность (ОВИН) – редкое иммунодефицитное состояние, классическим проявлением которого является рецидивирующая инфекция. Помимо инфекционных осложнений, при ОВИН нередко встречаются и другие поражения, такие как злокачественные новообразования, аутоиммунные состояния, возникающие в результате аномального клеточного иммунитета. Часто в патологический процесс вовлекаются легкие. Представлено клиническое наблюдение за пациентом с ОВИН, осложненной гранулематозно-лимфоцитарной интерстициальной болезнью легких.
Ключевые слова: гранулематозно-лимфоцитарная интерстициальная болезнь легких, первичный иммунодефицит.
Добровольное информированное согласие. От пациента получено письменное согласие на использование медицинских данных без указания персональных.
Общая вариабельная иммунная недостаточность (ОВИН) – это первичный иммунодефицит, характеризуемый низким уровнем сывороточных иммуноглобулинов (Ig) и неспособностью вырабатывать специфические антитела, что приводит к рецидивирующим бактериальным инфекциям [1]. Несмотря на то, что ОВИН относится к редким состояниям, эпидемиологические данные в разных популяциях существенно различаются. Например, по данным Европейского общества иммунодефицитов, в Нидерландах и Великобритании распространенность ОВИН составляет около 11 случаев на 100 тыс., тогда как в России этот показатель на 2 порядка ниже – всего 0,1 случая на 100 тыс. [2]. Хотя традиционно ОВИН рассматривается как состояние, манифестирующее в детском возрасте, по данным одного из недавних исследований показано, что > 50 % случаев ОВИН клинически проявились уже у взрослых пациентов [3].
Помимо инфекционных осложнений, при ОВИН нередко встречаются и другие поражения, такие как злокачественные новообразования, аутоиммунные состояния (наиболее распространена аутоиммунная цитопения, сообщается также о ревматоидном артрите, волчанке и первичном билиарном циррозе) и лимфопролиферативные заболевания [4]. Также в легких нередко развиваются неинфекционные патологические процессы, наиболее часто – бронхиальная астма, констриктивный и фолликулярный бронхиолит и бронхоэктазы, а среди интерстициальных болезней чаще всего упоминается об организующейся пневмонии, саркоидозе или саркоидных реакциях и лимфоцитарной пневмонии [5, 6]. Особое место среди легочных осложнений ОВИН занимает т. н. гранулематозно-лимфоцитарная интерстициальная болезнь легких (ГЛИБЛ), диагностика которой вызывает особые затруднения у морфологов, радиологов и клиницистов.
Впервые термин ГЛИБЛ применен в 2004 г., когда C.A.Bates et al. при помощи видеоторакоскопической биопсии легких у 5 из 18 пациентов с ОВИН и диффузными радиологическими изменениями в легких гистологически и одновременно в разных комбинациях выявлены лимфоцитарная интерстициальная пневмония, фолликулярный бронхиолит, лимфоидная гиперплазия и ненекротизирующие саркоидные гранулемы [7]. Клинически у всех этих больных в той или иной степени наблюдались одышка и спленомегалия и отмечался худший прогноз. В дальнейшем термин ГЛИБЛ стал использоваться у пациентов с сочетанием нескольких радиологических или морфологических паттернов поражения ткани легких у больных ОВИН.
Первым и пока единственным консенсусом по ГЛИБЛ является документ рабочей группы British Lung Foundation / United Kingdom Primary Immunode ficiency Network, по данным которого ГЛИБЛ определяется как «самостоятельное интерстициальное заболевание легких, имеющее характерные клинические и патологические черты, развивающееся у пациентов с ОВИН, ассоциированное с лимфоцитарной инфильтрацией и / или гранулематозным поражением легких, при условии исключения других известных состояний» [8].
ГЛИБЛ встречается у 8–22 % пациентов с ОВИН и ассоциируется с более высокой летальностью [9]. Средняя выживаемость у таких больных снижена более чем на 50 % [4]. А.Mannina et al. к предикторам развития ГЛИБЛ у пациентов с ОВИН отнесены гиперспленизм и полиартрит [10], в исследовании S.Hartono et al. таковыми являлись спленомегалия, присутствие в анамнезе аутоиммунной тромбоцитопенической пурпуры и гемолитической анемии, а также низкий уровень IgA [11].
Клиническая картина ГЛИБЛ неспецифична. Основными симптомами являются умеренно выраженные кашель и одышка. При присоединении вторичной бронхиальной инфекции могут появиться лихорадка, гнойная мокрота. У 76 % больных выявляется спленомегалия, у 25 % – полиартрит (для сравнения: в группе ОВИН без ГЛИБЛ такие находки отмечаются в 11 и 7 % случаев соответственно). В анализах крови примерно у 50 % больных выявляется цитопения [10]. В целом ГЛИБЛ расценивается как легочное проявление системного воспалительно-гранулематозного процесса при ОВИН с вовлечением лимфатических узлов, селезенки, печени, костного мозга и других органов [12].
Показатели спирометрии могут длительно оставаться в пределах нормальных значений. В целом даже при значительных изменениях по данным компьютерной томографии высокого разрешения (КТВР) органов грудной клетки (ОГК) снижение легочных объемов и диффузионной способности легких выражены довольно умеренно [10].
По данным КТВР выявляются следующие типичные особенности ГЛИБЛ:
Нередкой находкой являются периферические бронхоэктазы (~ 40%) и утолщение стенок бронхов (> 50% случаев), возможно появление «воздушных ловушек» и симптома мозаичной перфузии. Указанные изменения максимально представлены в нижних и средних отделах легких, изолированное поражение верхних долей практически не встречается и, скорее всего, свидетельствует в пользу оппортунистических инфекций, нежели ГЛИБЛ [10]. Периферическая и медиастинальная лимфаденопатия выявляется у 40 % больных ГЛИБЛ [13].
Поскольку организующаяся пневмония – довольно частая патологическая находка при ГЛИБЛ, по данным КТВР ОГК могут наблюдаться характерные изменения – зоны консолидации и «матового стекла» разной формы и размеров с перибронховаскулярным распределением, обратный симптом гало. Также характерным для пациентов с ОВИН в целом и ГЛИБЛ в частности является увеличение селезенки, обычно попадающей в срез при выполнении КТВР ОГК [14]. При проведении позитронно-эмиссионной томографии с 2-[(18) F]-фтор-2-дезокси-d-глюкозой в случае ГЛИБЛ выявляется ее повышенный захват как в ткани легких, так и в лимфатических узлах с редукцией степени накопления радиофармпрепарата на фоне лечения цитотстатическими препаратами и ритуксимабом [15].
Типичными гистопатологическими признаками ГЛИБЛ являются перибронхиолярная лимфоидная пролиферация, лимфоцитарная интерстициальная инфильтрация с преобладанием CD4 + -клеток, гранулематозное воспаление с плохо сформированными гранулемами без некроза. Как правило, данные изменения одновременно присутствуют у одного пациента в разных участках легкого, что нередко, особенно при ограниченном объеме биопсийного материала, приводит к ошибочной диагностике саркоидоза (саркоидной реакции), лимфоцитарной интерстициальной пневмонии или нодулярной лимфоидной гиперплазии. Более редкими находками могут быть фокусы организующейся пневмонии и разной степени выраженности интерстициального фиброза [4, 8, 16].
Дифференциальный диагноз следует проводить с инфекционными поражениями легких, лимфопролиферативными процессами (лимфома, лимфоидная гиперплазия) и другими интерстициальными заболеваниями (лимфоцитарная интерстициальная пневмония, организующаяся пневмония, фолликулярный бронхиолит), реже – с неспецифической интерстициальной пневмонией, саркоидозом, экзогенным аллергическим альвеолитом, метастатическим поражением легких, муцинозной аденокарциномой [1, 17]. У 20–30 % пациентов с ОВИН развиваются аутоиммунные заболевания [5]. Помимо упомянутых аутоиммунной цитопении и полиартрита, могут быть индуцированы болезнь Шегрена и васкулиты со вторичным поражением легких, при которых также требуется дифференциальный диагноз с ОВИН.
Для исключения инфекционной природы патологических изменений в легких у всех пациентов с ОВИН следует выполнять бронхоальвеолярный лаваж с исследованием лаважной жидкости на оппортунистические возбудители (микобактерии, грибки, респираторные вирусы, Pneumocystis jirovecii).
Для диагноза ГЛИБЛ рекомендуется проведение биопсии легких методом видеоторакоскопической биопсии легких с биопсией как минимум из 2 долей легких [8]. Однако эксперты полагают, что в ближайшем будущем методом выбора для гистологической верификации диагноза станет трансбронхиальная криобиопсия [12].
Наибольшие сложности диагноз представляет в случае, если ГЛИБЛ является первым клиническим проявлением ОВИН [17].
При выявлении смешанного паттерна интерстициального и очагового поражения по данным КТВР ОГК или в биопсийном материале, особенно у молодых пациентов, требуется определение уровня сывороточных Ig для исключения дебюта ОВИН с ГЛИБЛ.
Рандомизированные клинические исследования терапии ГЛИБЛ не проводились. У асимптомных пациентов с ГЛИБЛ и сохраненной легочной функцией требуется пересмотр дозы и режимов заместительной терапии Ig [12]. У больных с клиническими проявлениями и / или нарушением функции внешнего дыхания в качестве терапии первой линии используются системные глюкокортикостероиды в средней суточной дозе 40 мг преднизолона. Возможны стартовые комбинации преднизолона с азатиоприном или микофенолата мофетилом [8]. В качестве препаратов второй линии рассматриваются азатиоприн и микофенолата мофетил, возможно, в комбинации с ритуксимабом. По данным N.M.Chase et al., у пациентов, резистентных к терапии глюкокортикостероидами, в результате терапии комбинацией ритуксимаба и азатиоприна, а при непереносимости последнего – ритуксимаба и 6-меркаптопурина в течение 18 мес. наблюдались значительный регресс проявлений заболевания по данным КТВР ОГК и улучшение функциональных показателей [18]. В литературе также встречаются описания случаев успешного применения циклоспорина, ингибиторов фактора некроза опухоли-α, сиролимуса, такролимуса а также абатацепта [19]. Консенсус по длительности лечения, критериев снижения доз препаратов, показаний к прекращению терапии ГЛИБЛ в настоящее время не разработан.
Таким образом, диагностика ГЛИБЛ и выбор тактики ведения таких пациентов представляют большие трудности; при этом, по-видимому, в большинстве случаев требуется междисциплинарное обсуждение совокупности клинических, радиологических и морфологических данных. В качестве иллюстрации приводится клиническое наблюдение.
Пациент 29 лет с ОВИН, получавший лечение в клинике Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства, при поступлении предъявлял жалобы на редкий непродуктивный кашель, хрипы в грудной клетке, одышку при физической нагрузке 0–1 (mMRC), слабость. В анамнезе – ветряная оспа, двусторонний синусит в возрасте 10 лет, двусторонняя пневмония трижды за период 2015–2016 гг. (разрешение по данным радиологического исследования после антибактериальной терапии), Herpes zoster в июне 2016 г. С 2015 г. регистрировалась тромбоцитопения до 50 × 109 / л. В этом же году пациенту установлен диагноз ОВИН, проводилось лечение внутривенными Ig. С начала 2016 г. отмечаются увеличение шейных, аксиллярных, забрюшинных, тазовых, внутригрудных лимфатических узлов, спленомегалия и гепатомегалия (см. таблицу).
Таблица: Результаты лабораторных исследований от февраля 2016 г.
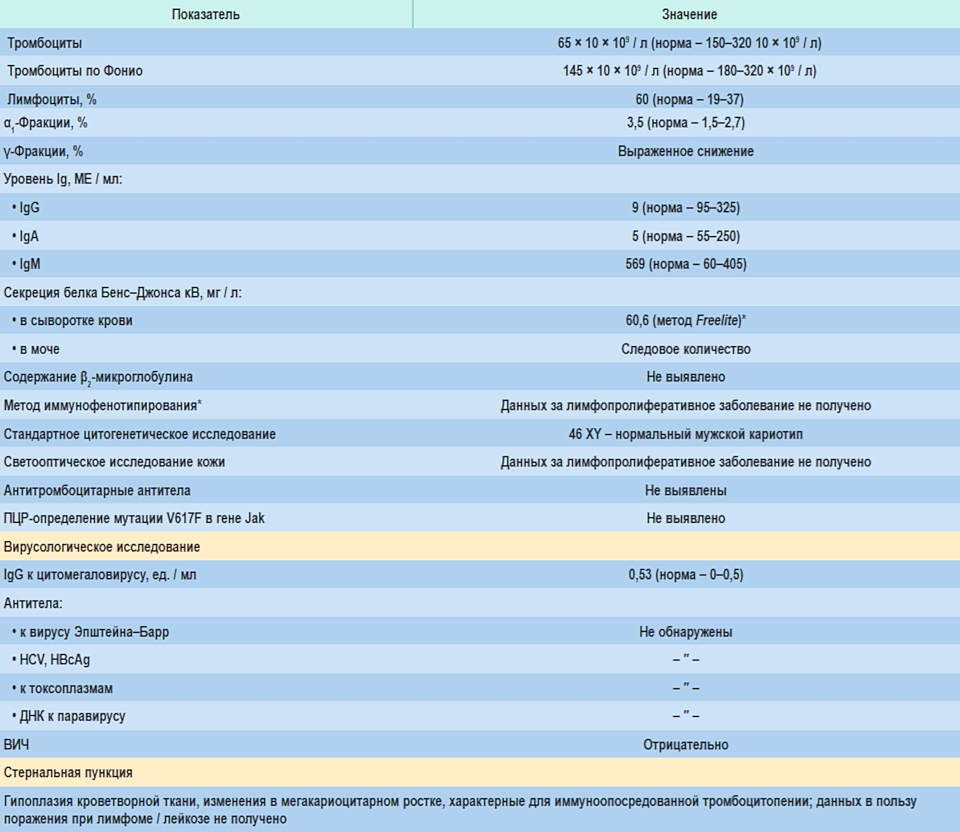
Примечание: Ig – иммуноглобулин; ПЦР – полимеразная цепная реакция; HCV – вирус гепатита С; HBсAg – поверхностный антиген вируса гепатита В; ВИЧ – вирус иммунодефицита человека; * – при повторных обследованиях – отрицательно.
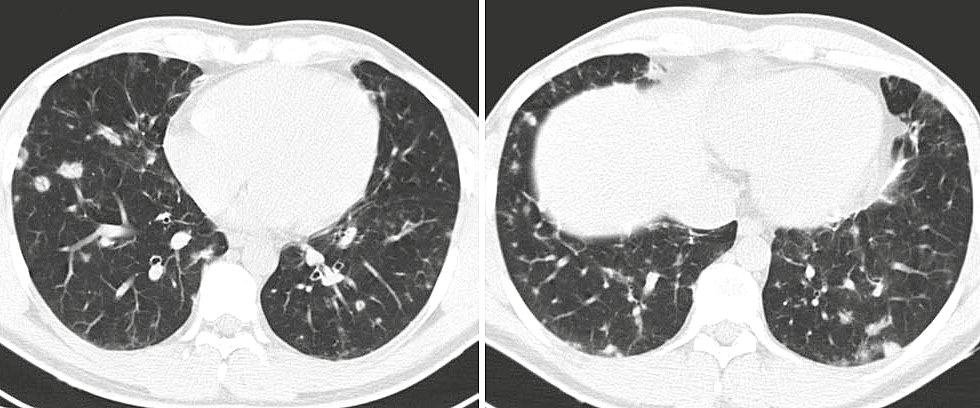
Рис. 1. Компьютерная томограмма высокого разрешения органов грудной клетки у пациента с общей вариабельной иммунной недостаточностью. В нижних отделах обоих легких визуализируются множественные очаги округлой формы разных размеров с перилимфатическим распределением, у части из которых отмечаются четкие контуры и высокая плотность, у остальных – размытые границы и более низкая плотность. Субплеврально определяются несколько участков «матового стекла», отдельные утолщенные междольковые перегородки.
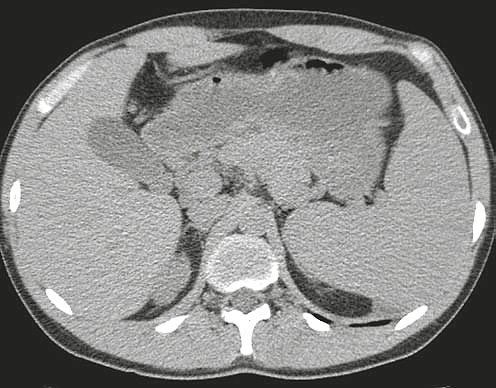
Рис. 2. Компьютерная томограмма брюшной полости пациента с общей вариабельной иммунной недостаточностью. Визуализируются селезенка больших размеров, увеличенная печень, забрюшинная лимфаденопатия.
С июля 2016 г. в легких определяется диссеминированный процесс – множественные очаги разной плотности и размеров, фокусы «матового стекла» с максимальной выраженностью в нижних отделах легких (рис. 1). В брюшной полости визуализируются селезенка гигантских размеров, гепатомегалия, увеличенные забрюшинные лимфатические узлы (рис. 2). Иммунофенотипирование лимфоцитов периферической крови, трепанобиопсия костного мозга позволили исключить лимфому и гемобластоз. Проведен курс лечения противотуберкулезными препаратами без существенного клинического и радиологического эффекта. С целью верификации диагноза проведена видеоторакоскопическая биопсия из нижней доли левого легкого. Морфологическое и иммуногистохимическое исследование проводилось в 4 федеральных научно-исследовательских учреждениях, при этом получены следующие заключения:
Таким образом, несмотря на достаточный объем материала, хотя и взятого в пределах 1 доли, 4 морфологами даны разные заключения относительно характера заболевания легких. Данный случай обсуждался на междисциплинарной комиссии. В связи со смешанным радиоморфологическим паттерном поражения легких (по данным КТВР ОГК – очагово-интерстициальный паттерн, при гистологическом исследовании – лимфоидная гиперплазия и инфильтрация, неказеозная гранулема), а также системной лимфопролиферативной реакцией, гепатоспленомегалией и аутоиммунной тромбоцитопенией, коллегиально принято решение о диагнозе ГЛИБЛ.
1. Cunningham-Rundles C., Bodian C. Common variable immunodeficiency: clinical and immunological features of 248 patients. Clin. Immunol. 1999; 92 (1): 34–48. DOI: 10.1006/clim.1999.4725.
2. Odnoletkova I., Kindle G., Quinti I. et al. The burden of common variable immunodeficiency disorders: a retrospective analysis of the European Society for Immunodeficiency (ESID) registry data. Orphanet J. Rare Dis. 2018; 13 (1): 201. DOI: 10.1186/s13023-018-0941-0.
3. Baloh C., Reddy A., Henson M. et al. 30-year review of pediatricand adult-onset CVID: clinical correlates and prognostic indicators. J. Clin. Immunol. 2019; 39 (7): 678–687. DOI: 10.1007/s10875-019-00674-9.
4. Amika A.K., Funkhouser W., Handly B. et al. Granulomatous-lymphocytic interstitial lung disease in 22q11.2 deletion syndrome: a case report and literature review. Curr. Allergy Asthma Rep. 2018; 18 (3):14. DOI:10.1007/s11882-018-0769-7.
5. Gupta S., Pattanaik D., Krishnaswamy G. Common variable immune deficiency and associated complications. Chest. 2019; 156 (3):579–593. DOI: 10.1016/j.chest.2019.05.009.
6. Yazdani R., Abolhassani H., Asgardoon M.H. et al. Infectious and noninfectious pulmonary complications in patients with primary immunodeficiency disorders. J. Investig. Allergol. Clin. Immunol. 2017;27 (4): 213–224. DOI: 10.18176/jiaci.0166.
7. Bates C.A., Ellison M.C., Lynch D.A. et al. Granulomatous-lymphocytic lung disease shortens survival in common variable immunodeficiency. J. Allergy Clin. Immunol. 2004; 114 (2): 415–421. DOI:10.1016/j.jaci.2004.05.057.
8. Hurst J.R., Verma N., Lowe D. et al. British lung foundation/United Kingdom primary immunodeficiency network consensus statement on the definition, diagnosis, and management of granulomatous-lymphocytic interstitial lung disease in common variable immunodeficiency disorders. J. Allergy Clin. Immunol. Pract. 2017; 5 (4): 938–945. DOI: 10.1016/j.jaip.2017.01.021.
9. Xiao X., Miao Q., Chang C. et al. Common variable immunodeficiency and autoimmunity – an inconvenient truth. Autoimmun. Rev. 2014; 13 (8): 858–864. DOI: 10.1016/j.autrev.2014.04.006.
10. Mannina A., Chung J.H., Swigris J.J. et al. Clinical predictors of a diagnosis of common variable immunodeficiency-related granulomatous-lymphocytic interstitial lung disease. Ann. Am. Thorac. Soc. 2016; 13 (7): 1042–1049. DOI: 10.1513/annalsats.201511-728oc.
11. Hartono S., Motosue M.S., Khan S. et al. Predictors of granulomatous lymphocytic interstitial lung disease in common variable immunodeficiency. Ann. Allergy Asthma Immunol. 2017. 118 (5): 614–620. DOI: 10.1016/j.anai.2017.01.004.
12. Cinetto F., Scarpa R., Pulvirenti F. et al. Appropriate lung management in patients with primary antibody deficiencies. Expert Rev. Respir. Med. 2019; 13 (9): 823–838. DOI: 10.1080/17476348.2019.1641085.
13. Torigian D., LaRosa D., Levinson A. et al. Granulomatous-lymphocytic interstitial lung disease associated with common variable immunodeficiency: CT finding. J. Thorac. Imaging. 2008; 23 (3):162–169. DOI: 10.1097/rti.0b013e318166d32f.
14. Cereser L., Giromettib R., d’Angelo P. et al. Humoral primary immunodeficiency diseases: clinical overview and chest high-resolution computed tomography (HRCT) features in the adult population. Clin. Radiol. 2017; 72 (7): 534–542. DOI: 10.1016/j.crad.2017.03.018.
15. Jolles S., Carne E., Brouns M. et al. FDG PET-CT imaging of therapeutic response in granulomatous lymphocytic interstitial lung disease (GLILD) in common variable immunodeficiency (CVID). Clin. Exp. Immunol. 2017; 187 (1): 138–145. DOI: 10.1111/cei.12856.
16. Rao N., Mackinnon A.C., Routes J.M. et al. Granulomatous and lymphocytic interstitial lung disease (GLILD): a spectrum of pulmonary histopathological lesions in common variable immunodeficiency (CVID) – histological and immunohistochemical analysis of 16 cases. Hum. Pathol. 2015; 46 (9): 1306–1314. DOI: 10.1016/j.humpath.2015.05.011.
17. Tashtoush B., Memarpour R., Ramirez J. et al. Granulomatous-lymphocytic interstitial lung disease as the first manifestation of common variable immunodeficiency. Clin. Respir. J. 2018; 12 (1): 337–343. DOI: 10.1111/crj.12511.
При цитировании или копировании статей гиперссылка на сайт https://profaveryanov.com обязательна!