от профессора Аверьянова
Дышится легче
Авторы: А.В. Аверьянов, А.Г. Сотникова
Александр Вячеславович Аверьянов – докт. мед. наук, главный науч. сотр. отдела фундаментальной пульмонологии ФГБУ "НИИ пульмонологии" ФМБА России, рук. центра пульмонологии ФГБУ "Федеральный научно-клинический центр" ФМБА России, Москва.
Анна Геннадьевна Сотникова – науч. сотр. лаборатории клеточных технологий ФГБУ "НИИ пульмонологии" ФМБА России, зав. пульмонологическим отделением ФГБУ "Федеральный научно-клинический центр" ФМБА России, Москва.
Идиопатический легочный фиброз – одно из наиболее распространенных диффузных паренхиматозных заболеваний легких, характеризующееся прогрессирующим течением с медианой выживаемости, не превышающей нескольких лет. Среди новых направлений в лечении этого заболевания наименее изученной областью являются клеточные технологии. Представленный обзор литературы посвящен теоретическим основам применения стволовых клеток при экспериментальном легочном фиброзе и идиопатическом легочном фиброзе, результатам первых клинических исследований в данной области.
Ключевые слова: идиопатический легочный фиброз, ИЛФ, стволовые клетки, клеточные технологии, клинические исследования, безопасность.
Идиопатический легочный фиброз (ИЛФ) – наиболее частая форма идиопатических интерстициальных пневмоний и одно из самых распространенных диффузных паренхиматозных заболеваний легких наряду с саркоидозом, поражениями легких при системных заболеваниях соединительной ткани и экзогенным аллергическим альвеолитом [1, 2]. Среди хронических интерстициальных заболеваний легких ИЛФ имеет наибольшие темпы прогрессирования и худшие показатели смертности, сопоставимые с наиболее агрессивными формами рака, с медианой выживаемости 3–4 года [3]. Несмотря на появление в арсенале врачей двух антифиброзных препаратов (нинтеданиб и пирфенидон), их доступность, особенно в странах с низким уровнем финансирования здравоохранения, остается недостаточной. Кроме того, большое количество побочных эффектов, а также существенная доля пациентов, у которых не достигается ответ на антифиброзную терапию, не позволяют признать полностью удовлетворительными возможности лечения больных ИЛФ. В связи с изложенным активный поиск новых перcпектив в помощи пациентам с ИЛФ ведется во многих странах мира. Одно из таких направлений – трансплантация стволовых клеток (СК) [4]. Целью настоящей статьи является обзор текущего состояния проблемы и возможных перспектив применения клеточных технологий при ИЛФ.
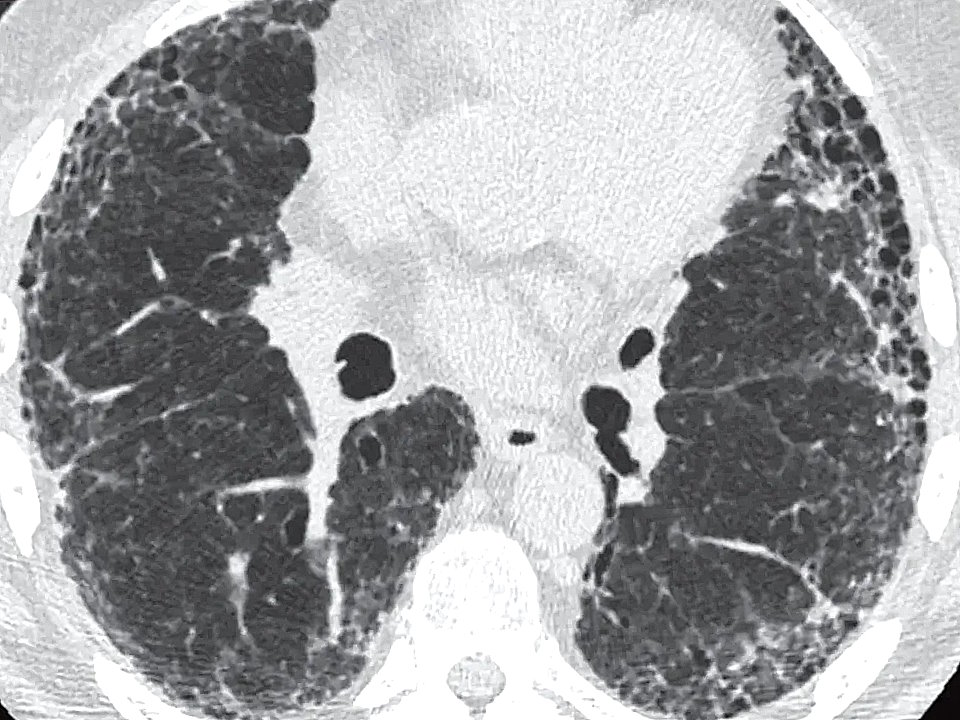
КТ при идиопатическом легочном фиброзе с интерстициальной пневмонией в базальных отделах
В первое десятилетие XXI века СК рассматривались как многообещающее, универсальное средство для лечения ряда тяжелых, прогрессирующих воспалительных, дегенеративных и опухолевых заболеваний [5, 6]. Такое мнение было основано как на успехе экспериментальных исследований, в которых изучалось использование различных типов СК на животных моделях, так и на представлениях о возможности встраивания трансплантированных клеток в поврежденный орган или ткань, в том числе в легкие, с их последующей регенерацией [7–9]. Наша страна, ученым которой принадлежит приоритет в открытии гемопоэтических СК (А.А. Максимов) и мезенхимальных СК (МСК) (А.Я. Фриденштейн), не оставалась в стороне от разработки этого перспективного направления. В 2002 г. решением Президиума Российской академии медицинских наук была утверждена отраслевая программа "Новые клеточные технологии – медицине", обозначившая стратегические направления, на которых должны были сосредоточить усилия отечественные ученые в области биологических и клинических исследований СК. Увы, среди областей медицины, отмеченных в этой программе как приоритетные для клеточных технологий, пульмонология отсутствовала.
Между тем в западных странах активно изучались эффекты клеточной терапии на экспериментальных моделях таких заболеваний легких, как эмфизема, хроническая обструктивная болезнь легких, легочная гипертензия, муковисцидоз, инфекционные поражения дыхательных путей, опухоли легкого и ИЛФ [10]. По большинству из них, за исключением рака легкого, были продемонстрированы оптимистичные результаты, позволяющие рассматривать клеточные технологии в качестве клинической перспективы для лечения некурабельных болезней органов дыхания [11]. Особенно обнадеживающими казались данные по лечению экспериментального фиброза легких как модели ИЛФ, для терапии которого на тот период не существовало ни одного лекарственного препарата с доказанной эффективностью [4].
Следует отметить, что теоретические основания для применения СК за последние 20 лет претерпели существенные изменения. Концепция пластичности (приживаемости) трансплантированных СК в дыхательных путях с регенерацией органов и тканей уступила свое место паракринной гипотезе, в соответствии с которой основным механизмом клеточной терапии является секреция СК большого числа биологически активных субстанций, оказывающих противовоспалительное, иммунорегуляторное и ангиогенное действие [12].
Доказательством этой гипотезы служат результаты экспериментальных исследований, в том числе работы, в которых было установлено, что кондиционная среда (среда, на которой культивируются СК) обладает практически такой же активностью, как и сами клетки, подавляя апоптоз эпителиальных и эндотелиальных клеток, тормозя эпителиально-мезенхимальную трансформацию, активированные фибробласты и воспалительный ответ за счет противовоспалительных цитокинов и хемокинов (IL-1ra (антагонист рецептора интерлейкина-1), CXCR3 (хемокиновый рецептор 3 семейства СХС), CCR5 (СС-рецептор хемокина 5)), молекул адгезии (ICAM-1 (молекулы межклеточной адгезии 1-го типа) и VCAM-1 (молекулы адгезии сосудистого эндотелия 1-го типа)), факторов роста (HGF (фактор роста гепатоцитов), VEGF (фактор роста эндотелия сосудов), EGF (эпидермальный фактор роста), KGF (фактор роста кератиноцитов)) и др. [13–15].
Среди различных типов СК наиболее перспективными с точки зрения безопасности применения у человека являются МСК, именно они чаще всего используются в экспериментальных и клинических исследованиях [4, 16]. Мезенхимальные СК – субпопуляция стромальных клеток, представленных во многих органах и тканях, но в максимальной степени в костном мозге, жировой ткани, фетальном материале, пуповинной крови, амниотической жидкости и плаценте, которые чаще всего служат источниками получения МСК для последующего клинического применения. Особенностью МСК является их "иммунопривилегированность", благодаря которой они не вызывают иммунологического отторжения у HLA-несовместимых (HLA – человеческие лейкоцитарные антигены) индивидуумов [17].
Одну из первых работ по применению МСК из пуповинной крови при блеомицининдуцированном легочном фиброзе у мышей провели Y. Moodley et al., которые отметили, что у животных, получивших МСК интраназально или внутривенно, наблюдались достоверно более низкие уровни тканевой экспрессии трансформирующего фактора роста β, фактора некроза опухоли α, интерферона-γ, провоспалительных цитокинов, тканевых ингибиторов металлопротеиназ. В то же время экспрессия матриксной металлопротеиназы-2, обладающей ангиогенными и антифиброгенными свойствами, увеличивалась. Депозиция коллагена при введении МСК значительно уменьшалась [18].
Одновременно M. Kumamoto et al. продемонстрировали протективные эффекты МСК костного мозга в отношении развития блеомицинового воспаления и легочного фиброза у мышей [19]. В дальнейшем результаты нескольких десятков экспериментов на мелких животных (мыши и крысы) в той или иной степени доказали, что трансплантированные МСК из разных источников (костный мозг, жировая ткань, плацента, пуповинная кровь), причем не только аллогенные (донорские от того же вида животных), но и ксеногенные (от других видов животных и человека), снижают либо предотвращают развитие блеомициновой травмы и фиброза легких, а также стимулируют регенерацию поврежденной ткани, активируя собственные ниши МСК [20].
Интересен тот факт, что в единственной работе, в которой сравнивали антифиброзные эффекты и выживаемость у мышей с экспериментальным фиброзом при лечении пирфенидоном и МСК, было продемонстрировано преимущество последних [21]. Мы провели доклинические исследования у более крупных животных (кроликов) и установили, что МСК блокируют развитие блео-мицининдуцированного легочного фиброза и при их ингаляционном введении, если их респирабельная доза сопоставима с количеством, вводимым внутривенно [22].
Тем не менее существуют опасения в отношении возможного профибротического эффекта трансплантированных МСК. Это связано с тем, что у человека субпопуляция МСК костного мозга – фиброциты играют определенную роль в развитии патологических интерстициальных процессов в легких. Количество циркулирующих в крови фиброцитов увеличено у больных ИЛФ, повышается в период обострения болезни и служит неблагоприятным прогностическим фактором [23]. Фиброциты являются предшественниками фибробластов, и их фокусы обнаруживаются в легких у больных ИЛФ в отличие от здоровых [24]. Кроме того, повышение уровня МСК в жидкости бронхоальвеолярного лаважа служит предиктором развития облитерирующего бронхиолита в трансплантированных легких [25].
Еще одно опасение, связанное с применением аллогенного (донорского) клеточного материала, касается возможности развития иммунологического конфликта, даже несмотря на отсутствие антигенов гистосовместимости у МСК [26]. Наконец, активно обсуждались возможность неконтролируемого деления трансплантированных клеток в организме реципиента и их потенциальная туморогенность [27]. Однако последнее положение относится к наименее дифференцированному типу СК – эмбриональным СК, которые в большинстве стран запрещены для использования в клинических исследованиях. Все эти факты свидетельствуют о том, что трансплантация МСК у больных ИЛФ требует тщательного изучения в клинических исследованиях.
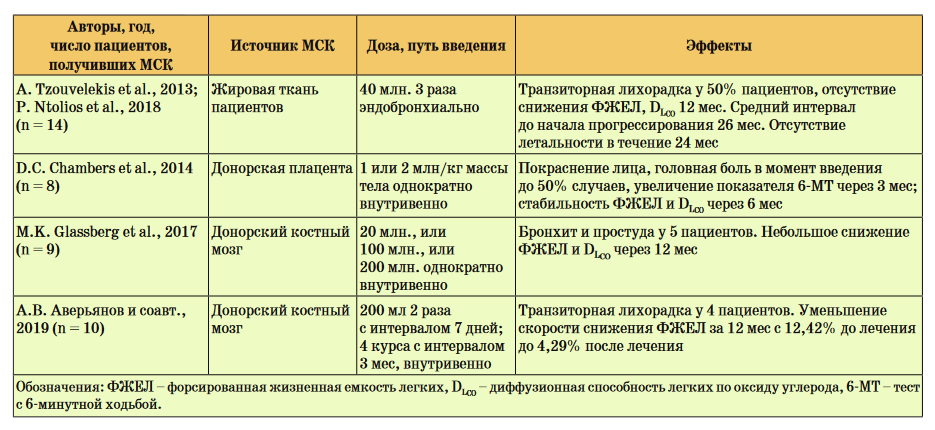
На сайте ClinicalTrials.gov по состоянию на 1 июня 2019 г. по ключевым словам “idiopathic pulmonary fibrosis” и “treatment” было зарегистрировано 87 исследований, большинство из которых касалось лекарственных препаратов, и лишь в 5 работах проводилось изучение безопасности и эффективности различных типов СК; еще 5 клинических исследований по оценке клеточной терапии ИЛФ были завершены, из них результаты 4 исследований опубликованы, а последнее, являющееся нашей собственной работой, было представлено на конгрессе Американского торакального общества и подготовлено к публикации (таблица).
Завершившиеся клинические исследования по безопасности и эффективности МСК у больных ИЛФ
Первым оригинальным исследованием по клеточной терапии фиброзного заболевания легких у человека является работа отечественных ученых Л.В. Курсовой и соавт., которые сначала в эксперименте, а затем у пациентов с лучевым пневмонитом и пневмофиброзом (как осложнения лучевой терапии онкологических заболеваний) продемонстрировали стабилизацию клинических, лабораторных, функциональных и перфузионных показателей. При этом в течение года у больных не было отмечено ни одного случая прогрессирования онкопроцесса и не было зафиксировано значимых побочных эффектов, связанных с внутривенной инфузией аутологичных МСК костного мозга [28]. И хотя это исследование не было рандомизированным и контролируемым и в нем изучался лучевой фиброз, а не ИЛФ, полученные данные продемонстрировали как минимум безопасность аллогенных МСК.
Результаты первого зарубежного клинического исследования по клеточной терапии ИЛФ (проведенного в Греции) были опубликованы в 2013 г. [29]. Пациентам с легким и среднетяжелым нарушением легочной функции (n = 14) эндобронхиально были выполнены 3 инстилляции суспензии аутологичных стромальных (мезенхимальных) клеток жировой ткани в дозе 0,5 млн/кг массы тела каждая с интервалом 1 мес. Были отмечены отсутствие каких-либо серьезных побочных эффектов и стабилизация форсированной жизненной емкости легких (ФЖЕЛ), диффузионной способности легких по оксиду углерода (DLCO) и показателя теста с 6-минутной ходьбой (6-МТ) в течение 12 мес. наблюдения. Спустя 2 года после первого введения клеток все пациенты были живы, а снижение функциональных параметров происходило через 12–24 мес. от начала терапии. Ни у одного пациента не было зафиксировано развития онкологических заболеваний [30].
D.C. Chambers et al. вводили внутривенно 1 или 2 млн/кг массы тела плацентарных МСК 8 больным ИЛФ с ФЖЕЛ более 50% от должной и DLCO более 25% от должной [31]. Авторы отметили хорошую переносимость клеточной терапии, а также достоверное увеличение показателя 6-МТ через 3 и 6 мес. после введения МСК. Такие показатели, как DLCO и степень фиброза легких по данным компьютерной томографии высокого разрешения (КТВР), оставались стабильными в течение периода наблюдения, а ФЖЕЛ после небольшого снижения в начале лечения вернулась к прежнему уровню через 6 мес.
Наконец, M.К. Glassberg et al. вводили аллогенные МСК костного мозга в дозах 20 млн., 100 млн. или 200 млн. путем однократной внутривенной инфузии 9 пациентам с ИЛФ [32]. Также, как и в других исследованиях, серьезных нежелательных событий, связанных с процедурой, не наблюдалось. Два пациента умерли в течение 12-месячного периода наблюдения вследствие обострения и прогрессирования заболевания вне связи с проведенной терапией. Что касается оценки ее эффективности, то наблюдалось небольшое увеличение показателя 6-МТ через 36 нед. после инфузии МСК, а общее снижение ФЖЕЛ и DL CO за период наблюдения составило 3,0% и 5,4% соответственно, что в целом меньше, чем, например, в популяции больных ИЛФ, получавших плацебо, в исследовании INPULSIS, где этот показатель составил 6,0–6,2% [33]. Таким образом, все авторы исследований I фазы по терапии МСК при ИЛФ отмечали хорошую переносимость и безопасность как аутологичных, так и донорских клеточных препаратов при их сомнительной эффективности, которая требует доказательств в рандомизированных и плацебо-контролируемых исследованиях.
Первое такое исследование было завершено нашей научной группой. Оно включало пациентов с наиболее тяжелыми и быстро прогрессирующими формами ИЛФ, у которых имело место снижение ФЖЕЛ или DLCO более 10% за предшествующие 12 мес. [34]. С учетом тяжести течения заболевания и отсутствия лекарственной альтернативы (на момент включения пациентов в исследование антифиброзные лекарственные препараты еще не были зарегистрированы в РФ), мы применили более агрессивную тактику с введением существенно большей дозы аллогенных МСК костного мозга. Двадцать больных ИЛФ с показателями ФЖЕЛ более 40% и DLCO более 20% от должных были рандомизированы в 2 группы по 10 пациентов в каждой, в одной из которых вводили внутривенно МСК в разовой дозе 200 млн в течение 7 дней. У пациентов, завершивших исследование, всего было проведено 4 таких курса с интервалами 3 мес. и суммарной дозой 1,6 × 109 клеток.
Побочные эффекты, зафиксированные в группах, в целом не различались, за исключением транзиторной лихорадки в течение 1–2 дней после инфузии и легкого озноба, чаще наблюдавшихся при терапии МСК. Уровень смертности между группами также не различался. Умерли по 2 пациента в каждой группе, причем это были наиболее тяжелые случаи заболевания с самыми низкими функциональными характеристиками. Из 5 пациентов, у которых исходная DLCO была менее 25% от должной и расстояние, пройденное в 6-МТ, менее 150 м, умерли 4 больных. По-видимому, на этой стадии заболевания клеточная терапия в предложенном режиме неэффективна.
В группе, получавшей лечение МСК, в целом наблюдалось достоверное уменьшение скорости снижения DLCO с 26-й недели лечения, а ФЖЕЛ – с 39-й недели, а также прирост показателя 6-МТ с 13-й недели в сравнении с плацебо. При этом индекс фиброза по данным КТВР в группах достоверно не различался. Конечно, небольшое число пациентов в группах и отсутствие ослепленности в дизайне исследования не позволяют с полной уверенностью рассуждать об эффективности и безопасности применения МСК при ИЛФ, тем не менее это исследование, на наш взгляд, является существенным шагом вперед, позволяющим планировать новые работы с более высокими дозами донорских клеточных препаратов, и в нем впервые была сделана попытка обосновать гипотезу о дозозависимости клеточной терапии.
Большинство вопросов, связанных с использованием клеточных технологий в лечении такого серьезного прогрессирующего заболевания, как ИЛФ, пока остаются без ответа. Это касается путей доставки клеточных препаратов, доз, кратности введения, механизмов их действия, краткосрочных и долгосрочных эффектов, этических аспектов. Наиболее хорошо доказанной является безопасность применения МСК из разных источников, которые рассматриваются как основной тип СК для изучения в клинических исследованиях. Тем не менее результаты первых цитированных выше работ дают определенные надежды и в отношении эффективности клеточной терапии. На наш взгляд, клеточные препараты должны расцениваться как многокомпонентные лекарства, требующие повторных введений для достижения и закрепления клинических и функциональных эффектов. Однако для подтверждения этого предположения необходимо как время, так и существенные ресурсы для организации клинических исследований с высоким уровнем доказательности.
1. Duchemann B, Annesi-Maesano I, Jacobe de Naurois C, Sanyal S, Brillet PY, Brauner M, Kambouchner M, Huynh S, Naccache JM, Borie R, Piquet J, Mekinian A, Virally J, Uzunhan Y, Cadranel J, Crestani B, Fain O, Lhote F, Dhote R, Saidenberg-Kermanac’h N, Rosental PA, Valeyre D, Nunes H. Preva lence and incidence of interstitial lung diseases in a multi-ethnic county of Greater Paris. The European Respiratory Journal 2017 Aug;50(2). pii:1602419. doi: 10.1183/13993003.02419-2016. Print 2017 Aug.
2. Thomeer M, Demedts M, Vandeurzen K; VRGT Working Group on Interstitial Lung Diseases. Registration of interstitial lung diseases by 20 centres of respiratory medicine in Flanders. Acta Clinica Belgica 2001 May-Jun;56(3):163-72.
3. Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology. The European Respiratory Journal 2010 Mar;35(3):496-504.
4. Toonkel RL, Hare JM, Matthay MA, Glassberg MK. Mesenchymal stem cells and idiopathic pulmonary fibrosis: potential for clinical testing. American Journal of Respiratory and Critical Care Medicine 2013 Jul;188(2):133-40.
5. Gol’dberg ED, Dygai AM, Zhdanov VV. Modern views on the problem of stem cells and potentialities of their use in medicine. Bulletin of Experimental Biology and Medicine 2005. Nov;140(5):588-92.
6. Mimeault M, Hauke R, Batra SK. Stem cells: a revolution in therapeutics-recent advances in stem cell biology and their therapeutic applications in regenerative medicine and cancer therapies. Clinical Pharmacology & Therapeutics 2007 Sep;82(3):252-64.
7. Aliotta JM, Passero M, Meharg J, Klinger J, Dooner MS, Pimentel J, Quesenberry PJ. Stem cells and pulmonary metamorphosis: new concepts in repair and regeneration. Journal of Cellular Physiology 2005 Sep;204(3):725-41.
8. Wang G, Bunnell BA, Painter RG, Quiniones BC, Tom S, Lanson NA Jr, Spees JL, Bertucci D, Peister A, Weiss DJ, Valentine VG, Prockop DJ, Kolls JK. Adult stem cells from bone marrow stroma differentiate into airway epithelial cells: potential therapy for cystic fibrosis. Proceedings of the National Academy of Sciences of the USA 2005 Jan;102(1):186-91.
9. Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, Neutzel S, Sharkis SJ. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell 2001 May;105(3):369-77.
10. Wecht S, Rojas M. Mesenchymal stem cells in the treatment of chronic lung disease. Respirology (Carlton, Vic.) 2016 Nov;21(8):1366-75.
11. Weiss DJ, Bertoncello I, Borok Z, Kim C, Panoskaltsis-Mortari A, Reynolds S, Rojas M, Stripp B, Warburton D, Prockop DJ. Stem cells and cell therapies in lung biology and lung diseases. Proceedings of the American Thoracic Society 2011 Jun;8(3):223-72.
12. Liu M, Ren D, Wu D, Zheng J, Tu W. Stem cell and idiopathic pulmonary fibrosis: mechanisms and treatment. Current Stem Cell Research & Therapy 2015;10(6):466-76.
13. Ortiz LA, DuTreil M, Fattman C, Pandey AC, Torres G, Go K, Phinney DG. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury. Proceedings of the National Academy of Sciences of the USA 2007 Jun;104(26):11002-7.
14. Cahill EF, Kennelly H, Carty F, Mahon BP, English K. Hepatocyte growth factor is required for mesenchymal stromal cell protection against bleomycin-induced pulmonary fibrosis stem cells. Stem Cells Translational Medicine 2016 Oct;5(10):1307-18.
15. Wang X, Gao JL, Zhao MM, Zhu HX, Tian YX, Li R, Jiang XH, Yu L, Tian JR, Cui JZ. Therapeutic effects of conditioned medium from bone marrow-derived mesenchymal stem cells on epithelial-mesenchymal transition in A549 cells. International Journal of Molecular Medicine 2018 Feb;41(2):659-68.
16. Li X, Yue S, Luo Z. Mesenchymal stem cells in idiopathic pulmonary fibrosis. Oncotarget 2017 May;8(60):102600-16.
17. Le Blanc K, Tammik C, Rosendahl K, Zetterberg E, Ringdén O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Experimental Hematology 2003 Oct;31(10):890-6.
18. Moodley Y, Atienza D, Manuelpillai U, Samuel CS, Tchongue J, Ilancheran S, Boyd R, Trounson A. Human umbilical cord mesenchymal stem cells reduce fibrosis of bleomycin-induced lung injury. The American Journal of Pathology 2009 Jul;175(1):303-13.
19. Kumamoto M, Nishiwaki T, Matsuo N, Kimura H, Matsushima K. Minimally cultured bone marrow mesenchymal stem cells ameliorate fibrotic lung injury. The European Respiratory Journal 2009 Sep;34(3):740-8.
20. Srour N, Thébaud B. Mesenchymal stromal cells in animal bleo mycin pulmonary fibrosis models: a systematic review. Stem Cells Translational Medicine 2015 Dec;4(12):1500-10.
21. Reddy M, Fonseca L, Gowda S, Chougule B, Hari A, Totey S. Human adipose-derived mesenchymal stem cells attenuate early stage of bleomycin induced pulmonary fibrosis: comparison with pirfenidone. International Journal of Stem Cells 2016 Nov;9(2):192-206.
22. Аверьянов А.В., Коноплянников А.Г., Забозлаев Ф.Г., Сотникова А.Г., Данилевская О.В., Коноплянников М.А., Татарский А.Р. Сравнительное исследование эффектов мезенхимальных стволовых клеток при различных методах доставки в экспериментальной модели фиброза легких. Клиническая практика 2018;9(4):4-14.
23. Moeller A, Gilpin SE, Ask K, Cox G, Cook D, Gauldie J, Margetts PJ, Farkas L, Dobranowski J, Boylan C, O’Byrne PM, Strieter RM, Kolb M. Circulating fibrocytes are an indicator of poor prognosis in idiopathic pulmonary fibrosis. American Journal of Respiratory and Critical Care Medicine 2009 Apr;179(7):588-94.
24. Andersson-Sjöland A, de Alba CG, Nihlberg K, Becerril C, Ramírez R, Pardo A, Westergren-Thorsson G, Selman M. Fibrocytes are a potential source of lung fibroblasts in idiopatic pulmonary fibrosis. The International Journal of Biochemistry & Cell Biology 2008;40(10):2129-40.
25. Badri L, Murray S, Liu LX, Walker NM, Flint A, Wadhwa A, Chan KM, Toews GB, Pinsky DJ, Martinez FJ, Lama VN. Mesenchymal stromal cells in bronchoalveolar lavage as predictors of bronchiolitis obliterans syndrome. American Journal of Respiratory and Critical Care Medicine 2011 Apr;183(8):1062-70.
26. Ntolios P, Janes SM. Mesenchymal stem cell therapy for lung diseases: oasis or mirage? Respiration 2013;85(4):279-80.
27. Simonson OE, Domogatskaya A, Volchkov P, Rodin S. The safety of human pluripotent stem cells in clinical treatment. Annals of Medicine 2015;47(5):370-80.
28. Курсова Л.В., Конопляников А.Г., Пасов В.В., Иванова И.Н., Полуэктова М.В., Коноплянникова О.А. Возможности применения аутологичных мезенхимальных стволовых клеток в лечении лучевых повреждений легких. Клеточные технологии в биологии и медицине 2009;6(2):108-12.
29. Tzouvelekis A, Paspaliaris V, Koliakos G, Ntolios P, Bouros E, Oikonomou A, Zissimopoulos A, Boussios N, Dardzinski B, Gritzalis D, Antoniadis A, Froudarakis M, Kolios G, Bouros D. A prospective, non-randomized, no placebo-controlled, phase 1b clinical trial to study the safety of the adipose derived stromal cells-stromal vascular fraction in idiopathic pulmonary fibrosis. Journal of Translational Medicine 2013 Jul;11:171.
30. Ntolios P, Manoloudi E, Tzouvelekis A, Bouros E, Steiropoulos P, Anevlavis S, Bouros D, Froudarakis ME. Longitudinal outcomes of patients enrolled in a phase Ib clinical trial of the adipose-derived stromal cells-stromal vascular fraction in idiopathic pulmonary fibrosis. The Clinical Respiratory Journal 2018 Jun;12(6):2084-9.
31. Chambers DC, Enever D, Ilic N, Sparks L, Whitelaw K, Ayres J, Yerkovich ST, Khalil D, Atkinson KM, Hopkins PM. A phase 1b study of placenta-derived mesenchymal stromal cells in patients with idiopathic pulmonary fibrosis. Respirology (Carlton, Vic.) 2014 Oct;19(7):1013-8.
32. Glassberg MK, Minkiewicz J, Toonkel RL, Simonet ES, Rubio GA, DiFede D, Shafazand S, Khan A, Pujol MV, LaRussa VF, Lancaster LH, Rosen GD, Fishman J, Mageto YN, Mendizabal A, Hare JM. Allogeneic human mesenchymal stem cells in patients with idiopathic pulmonary fibrosis via intravenous delivery (AETHER): a phase I safety clinical trial. Chest 2017 May;151(5):971-81.
33. Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, Cottin V, Flaherty KR, Hansell DM, Inoue Y, Kim DS, Kolb M, Nicholson AG, Noble PW, Selman M, Taniguchi H, Brun M, Le Maulf F, Girard M, Stowasser S, Schlenker-Herceg R, Disse B, Collard HR; INPULSIS Trial Investigators. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. The New England Journal of Medicine 2014 May;370(22):2071-82.
34. Averyanov A, Koroleva I, Sotnikova A, Konoplyannikov M, Lesnyak V, Danilevskaya O, Baklaushev V. Safety and efficacy of transplantation of high cumulative dose allogeneic bone marrow-derived mesenchymal stem cells in patients with idiopathic pulmonary fibrosis and rapid lung function decline. American Journal of Respiratory and Critical Care Medicine 2019;199:A2640.
A.V. Averiyanov and A.G. Sotnikova
Idiopathic pulmonary fibrosis is one of the most common diffuse parenchymal lung diseases characterized by progressive course with median survival of not more than few years. Among new approaches to the treatment of the disease cell technology is the least studied area. Literature review is devoted to theoretical foundations of the use of stem cells for experimental pulmonary fibrosis and idiopathic pulmonary fibrosis, the results of the first clinical studies in the field.
Key words: idiopathic pulmonary fibrosis, stem cells, cell technology, clinical research, safety.
При цитировании или копировании статей гиперссылка на сайт https://profaveryanov.com обязательна!